Chapitre 10 : Les solutions acides, basiques et neutres
Rappels sur les solutions
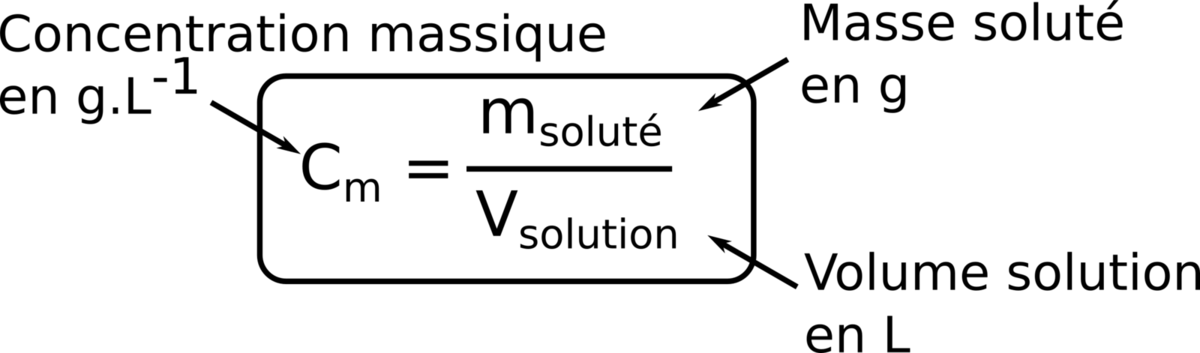


Prenons l'exemple d'une solution de chlorure de cobalt(II) obtenue en dissolvant 0,10 mol de chlorure de cobalt (II) solide CoCl2 dans 500 mL d'eau. La concentration de la solution de chlorure de cobalt est égale à la quantité de matière de CoCl2 divisée par le volume de la solution.
Concentration de la solution :
Lors de la dissolution d'1 mole de chlorure de cobalt il se forme 1 mole d'ions cobalt (II) (Co2+) et 2 moles d'ions chlorure (Cl-) :
CoCl2 --------->Co2+ + 2Cl-
La quantité d'ions chlorure en solution est le double de la quantité d'ion cobalt (II) : n(Cl-) = 2n(Co2+) = 2n(CoCl2)
La concentration molaire en ions chlorure [Cl-] est donc le double de la concentration de fabrication de la solution [Cl-]= 2C = 0,40 mol.L-1
[Co2+] = C = 0,20 mol.L-1
Vous comprenez ainsi pourquoi il est nécessaire de distinguer C et [X] alors que bien souvent elles sont l'une comme l'autre appelées simplement « concentration » La notation [X] correspond à une espèce X qui existe effectivement en solution. La solution de chlorure de cobalt ne contenant pas d'espèce CoCl2 mais seulement des ions distincts Co2+ et Cl- (en plus des molécules d'eau).
Le pH






