Chapitre 16 : Oxydoréduction
Un couple oxydant/réducteur est un ensemble de 2 entités chimiques qui peuvent se transformer l’une en l’autre par un simple échange d'électron(s).
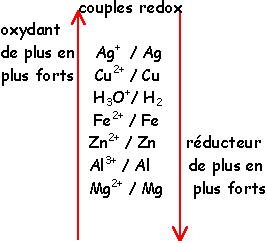
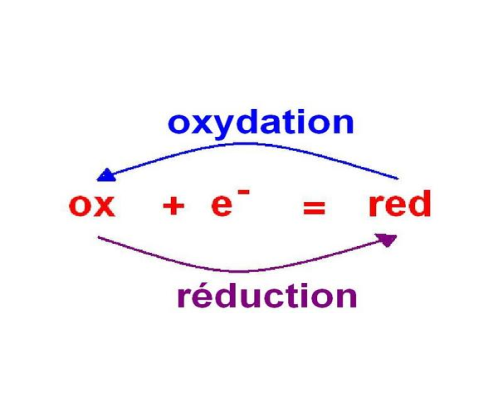
Une réaction d’oxydoréduction est donc une réaction entre l’oxydant d’un couple et le réducteur d’un autre.
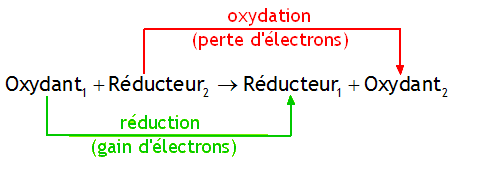
Equations d'oxydoréduction

Exercice intéractif : www.ostralo.net/equationschimiques/pages/p6a.htm
Utiliser des coefficients pour équilibrer le nombre d’électrons (le nombre d’électrons captés par l’oxydant doit correspondre au nombre d’électrons cédés par le réducteur).
Ecrire l’équation finale en ajoutant les 2 demi-équations de chaque côté du signe égal.
Exemple :
MnO4-(aq) + 8H+(aq) + 5e- = Mn2+(aq) + 4H2O(l) (x1)
Fe2+(aq) = Fe3+ (aq) + e- (x5)
MnO4-(aq) + 8H+(aq) + 5Fe2+(aq) ![]() Mn2+(aq) + 5Fe3+(aq) + 4H2O(l)
Mn2+(aq) + 5Fe3+(aq) + 4H2O(l)
