Chapitre 11 : acides et bases faibles
Rappels de première
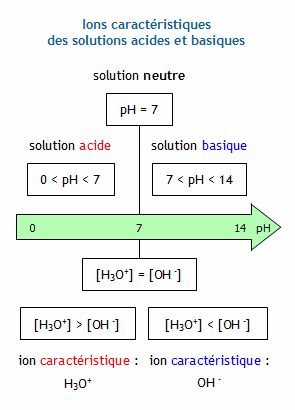
Le pH renseigne sur les concentrations en ions oxonium H3O+ et hydroxyde HO- dans une solution aqueuse grace à :
pH= - log[H3O+] et [H3O+]=10-pH
avec [H3O+] en mol.L-1
Rappel :
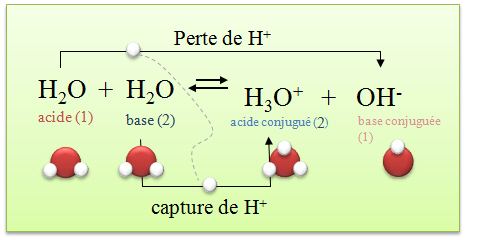
L'eau se décompose donc spontanément en ions hydroxyde et oxonium: ce phénomène est appelé autoprotolyse de l'eau.
Attention, ces ions apparaissent cependant en faible quantité.
Le produit ionique de l'eau
L'equilibre qui existe entre l'eau et les ions produits par autoprotolyse peut être décrit par la relation suivante:
Ke = [H3O+][OH-] où Ke est une constante appelée produit ionique de l'eau.
A 25°C elle a pour valeur Ke = 10-14
Acides et bases selon Bronsted :
Une réaction acido-basique ou acide - base est caractérisée par un transfert de proton H+ entre un acide et une base.
Un acide est une espèce chimique capable de libérer un proton H+ .
Une base est une espèce chimique capable de capter un proton H+ .

Couples acide /base
1) Définition :
Deux espèces chimiques constituent un couple acide / base s'il est possible de passer de l'un à l'autre par perte ou gain d'un proton H+
exemples : acide / base NH4+ / NH3 , H2O / HO-
2) Demi-équation acido-basique :
Soit AH / A- un couple acide / base .
Si AH est l'un des réactifs, il va donner sa base conjuguée : AH → A- + H+
Si A- est l'un des réactifs, il va donner son acide conjugué : A- + H+ → AH
Pour indiquer le fait que la réaction peut se faire dans les deux sens, on écrit :
AH = A- + H+ (l'acide est toujours à gauche du signe = )
exemple : C6H5COOH = C6H5COO- + H+
acide benzoïque ion benzoate
3) Couple acide-base de l'eau :
L'eau a des propriétés acido-basiques :
* c'est un acide : H2O = HO- + H+ couple H2O / HO-
ion hydroxyde
* c'est une base : H3O+ = H2O + H+ couple H3O+ / H2O
ion oxonium
Acides forts et faibles
Pour les acides forts, toutes les molécules sont dissociées avec l'eau : [H3O+] = C
Pour les acides faibles, toutes les molécules ne sont pas dissociées avec l'eau, il y a un équilibre.
Soit un couple acide base HA/A- dont la réaction avec l'eau est :
HAaq + H2O = A-aq + H3O+aq
La constante d'équilibre, Ka, appelée constante d'acidité de ce couple est :

On calcul également le pKa
pKa = -log(Ka)
pKa et Ka sont sans unité. La relation entre le pH et le pKa est :

Diagramme de prédominance

Les dosages
Pour déterminer la concentration d’une solution acide (pH<7) on peut la faire réagir avec une solution basique (pH>7), il s’agit d’un dosage ou d'un titrage.
De même, on déterminera la concentration d’une solution basique à l’aide d’une solution acide.

Lors d’un dosage, la réaction chimique doit être rapide et totale
On dit qu’on est à l’équivalence lorsqu’on change de réactif limitant (le réactif à titrer est entièrement consommé).
L'équivalence se repère par un saut de pH ou par un changement de couleur à l'aide d'un indicateur coloré.
