Chapitre 6 : Les glucides
Généralités sur les glucides


Les oses ne réagissent pas avec l’eau, on dit qu’ils ne sont pas hydrolysables. Ils sont directement assimilés par l’organisme, on parle de sucres rapides.
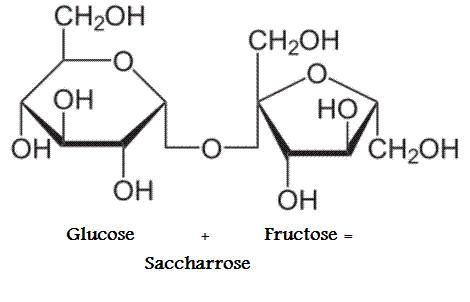
Les molécules d’oses peuvent se lier entre elles pour former d’autres glucides plus complexes, appelés osides. Les molécules de saccharose et de lactose sont formées à partir de 2 oses, on parle de diholosides.
D’autres comme l’amidon peuvent être constitués de centaines de molécules d’oses liées entres-elles, on parle de polyholosides.
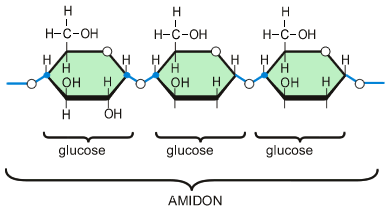
Toutes ces osides sont hydrolysables et forment des oses. Cette hydrolyse prend du temps, on parle de sucres lents.
Solubilité des glucides
L'eau est un solvant particulier, chaque molécule possède des charges partielles dues à un leger déplacement des électrons de la liaison covalente vers l'oxygène.
Une liaison Hydrogène peut se former entre un atome d'hydrogène portant une charge partielle positive et un atome d'une autre molécule portant une charge partielle négative (les contraires s'attirent).

Dans l’eau liquide, les molécules d’eau s’associent les unes aux autres sous la forme de paquets de grande taille qui se font et se défont en permanence à cause de l'agitation thermique. Par contre, en refroidissant le système, toutes les liaisons hydrogènes se forment et le liquide fige => on forme de la glace.
L'augmentation de volume observée lors de la solidification de l'eau est due à la formation de la 4è Liaison Hydrogène d'une molécule d'eau.

La solubilité des glucides s'explique par la possibilité de former des Liaisons Hydrogènes entre les glucides contenant des groupe hydroxyle -OH et les molécules d'eau.
On peut expliquer de même la grande solubilité de la plupart des alcool.
Préparation de solution

